深海生物资源在大健康产业中的应用进展
撰文/彭清云1、李鑫1、王小珍1、陈川威1、李若源1、杨德华1,2,*、王明伟1,2,3,4,*
1三亚深海化合物资源中心;2国家药物筛选中心和中国科学院受体结构与功能重点实验室;3上海科技大学生命科学与技术学院;4复旦大学基础医学院
*dhyang@simm.ac.cn or mwwang@simm.ac.cn
【摘要】21世纪是海洋世纪,深海作为蓝色海洋的重要组成部分,是中国参与全球治理的重要战略疆域。深海孕育了复杂而独特的生态系统,蕴藏着丰富的生物多样性。深海生物资源在生命科学和健康领域具有广阔的发展潜力和市场前景。本文主要介绍深海生物资源的研究方向和应用价值,盘点我国在这一领域的基本情况,分析当前的机遇和挑战,以期为我国可持续开发深海生物资源提供思路。
【关键词】深海科技,生物资源,大健康产业,药用开发
1.前言
海洋约占地球面积的71%,其中深海(国际上一般将其定义为水深大于或等于1000米的海域)占海洋面积的90%以上。深海是地球上最大的生物栖息地,拥有低温(或高温)、高压、高盐、缺氧、无光照和低营养等极端环境,孕育了复杂而特殊的生态系统,蕴藏着巨大的生物资源,具有广阔的开发利用潜力[1]。
深海生物资源备受世人重视,维护深海生物资源的多样性更是联合国和国际海底管理局等国际组织关注的焦点。习近平总书记指出“中国主要的海洋科技研究仍然与近海和海岸带相关,注重维护海洋生态系统的服务功能,但必须意识到,与远洋深海相关的重要资源能源、环境效应和生命过程问题已成为海洋科技研究的新焦点”[2]。
深海生物资源的种类与价值
深海生物主要指生活在1000米水体下(包括水体覆盖下的海底)的生物体,可分为深海微生物、深海动物和深海植物三大类,按其生活方式又分为浮游生物、游泳生物和底栖生物三大种。深海生物资源主要包括物种资源、基因资源及产物资源。深海具有独特的环境和生态系统,包括热液喷口、冷渗口、海山、冷水珊瑚礁和深渊等[3]。这些极端环境导致了生物的多样性及其独特的物理生化机制,在揭示生命起源与演化、医药开发、工业应用和环境保护等方面具有较高科研和实用价值。
深海生物资源与大健康产业
3.1 研究方向和应用价值
深海生物是当前的研究热点,其独特的遗传方式能产生出新颖多样的活性代谢产物[4]。深海生物资源在大健康产业中的研究方向主要有药物开发、化妆品、保健品和农工用品等(图1)。

图1 深海生物资源的研究方向
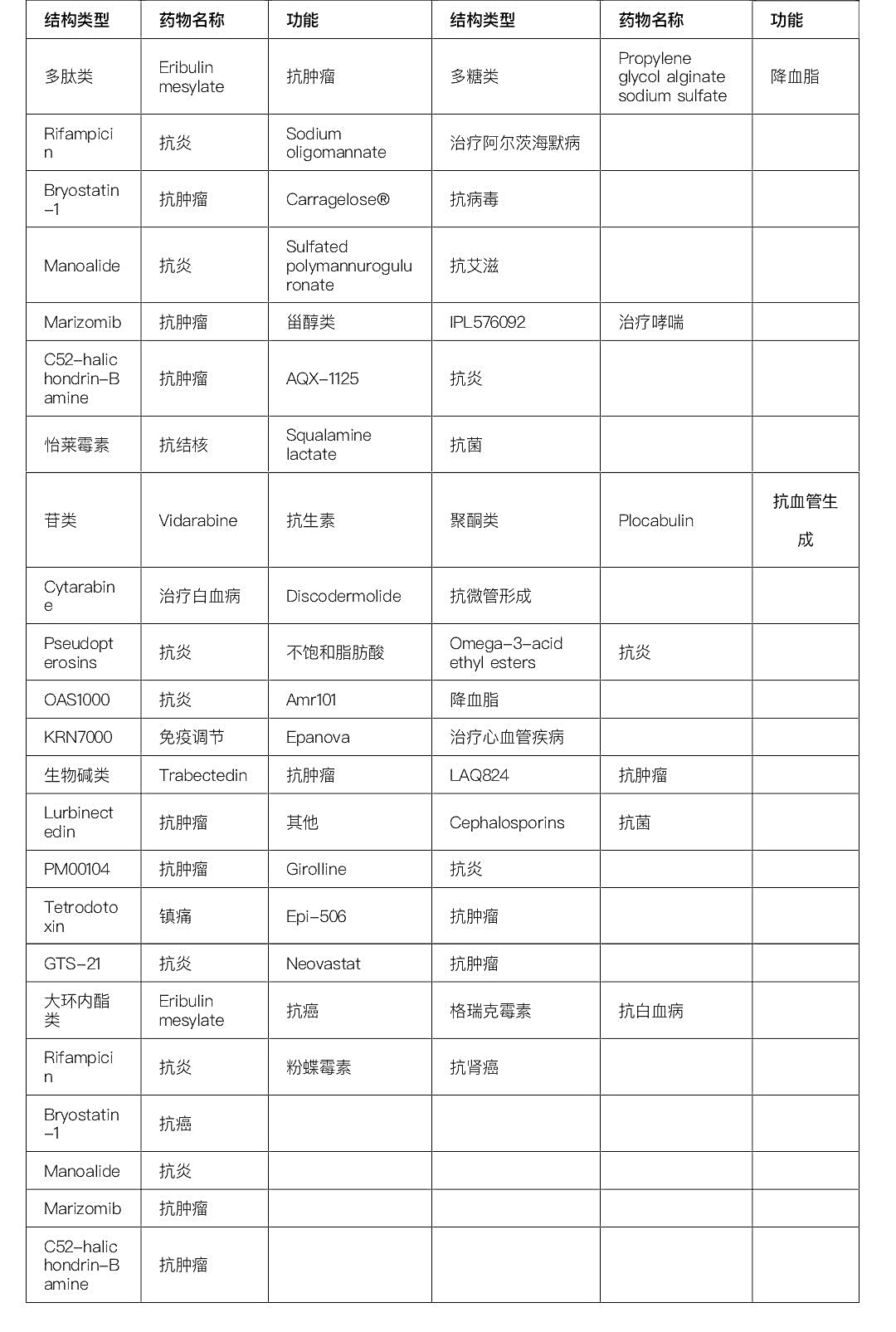
随着陆生资源日益枯竭,基于天然产物的新药开发难度加大,从深海生物资源中筛选先导化合物成为药物发现的重要途径,受到各个国家的重视[5]。我国在深海微生物药物研发领域处于国际领先水平,主要成果包括抗结核杆菌感染的怡莱霉素、抗白血病的格瑞克霉素和抗肾癌的粉蝶霉素等的原创研究[6, 7]。据统计,深海生物来源的药物有42种,其中3种来自中国,已获批上市的为15种(表1)[8]。目前对于深海生物药物的开发主要聚焦于治疗肿瘤、消炎镇痛、抗细菌和病毒感染等[6-9][8-10]。
深海生物资源既是新药创制的原点,也是化妆品开发的源头。深海生物能产生展现多种功能的活性代谢物,如抗衰老、抗氧化、皮肤美白和抗痤疮等,这些具有药妆潜力的活性分子也常用来开发功能性化妆产品[11-17]。其次,深海微生物也是重要的天然抗污损资源,一方面将其开发成防污涂料用于防治海洋生物污损,另一方面也可以进行污染物的降解[18, 19]。而生物农药则是深海生物资源的另一开拓方向,适合于农药产业的转型发展,其主要优点在于能够降低化学农药对生态环境所造成的污染[20-23]。此外,深海生物资源还被开发成为广泛应用的保健品,如作为脂质功能食品的不饱和脂肪酸,包括鱼油中的ω-3多不饱和脂肪酸、二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等[24-26]。
表1 在研和已经上市的深海药物
3.2 国内研究机构和成果
本世纪以来,我国沿海省市陆续建立了数十家海洋研究单位,形成了以青岛、上海、厦门和广州为中心的四大海洋技术中心[27]。我国目前共有176个海洋科研机构,近100家大专院校和科研院所从事深海研究,发表深海相关文献达上万篇,培养了一批深海大洋科研队伍,为我国开展深海科技、资源发掘、新药创制和成果转化提供了人才保障[28]。
中国科学院海洋研究所是中国最大的综合性深海大洋研究机构,该所发现深海细菌多糖能通过靶向I型胶原蛋白抑制肿瘤转移,为深入开发深海微生物资源提供了成功范例[29]。国家海洋局第三海洋研究所以开拓深海生物资源为重点,建立了堪称世界藏量最大、种类最多的海洋微生物菌种保藏管理中心。中国科学院深海科学与工程研究所以深海科技为主攻方向,而青岛海洋科学与技术试点国家实验室引领我国深海科学研究,构建了全球首个包含3万多个已知海洋化合物的海洋天然产物三维结构数据库,通过精确筛选,为“蓝色药库”推荐了131种苗头分子和20余个先导化合物。此外,我国台湾地区也设有台湾大学海洋研究所和台湾海洋科技研究中心等机构,从业人员达千人。
自本世纪初以来,我国深海生物基因资源的取样、分离、存储和开发能力迅速增强,迄今已经分离和鉴定出约18万余株深海极端微生物,其中含300个新品种,建立了上述菌种保藏管理平台,实现了我国深海生物资源的快速积累[28]。在深海微生物资源利用方面,目前已申请发明专利200多项,其中数十项获得授权[30]。在深海药物开发方面,世界药物专利数据库检索显示,我国跟深海有关的专利有2453条,深海药物专利有1175条,创新点主要集中在用途及制备方法,超过50%,而化合物结构专利占比仅为27%(图2)[31]。

图2 海洋药物领域专利主题分类统计
展望
采集获取和开发利用深海生物资源是发展海洋经济、建设海洋强国的重要内容。将深海生物资源应用于生命科学及大健康产业,有助于满足我国社会不断增长的物质与精神需求,提升经济效益和社会效益。深海生物资源的有效获取和安全保藏是保障其可持续应用的前提。我国深海科技装备水平的大幅提升带动了深海生物资源应用的快速发展[32]。2016年2月,国务院印发了“实施《中华人民共和国促进科技成果转化法》若干规定”,为深海生物资源应用于生命科学及大健康产业提供了政策支持。然而,我国在这一领域的研究能力和人才队伍与德国、法国、日本、美国及俄罗斯等海洋强国相比尚有差距,特别在采集装备、作业经验、数据储量和成果转化等方面亟待加强。因此,我们应该充分利用中国社会经济快速发展的契机,加强政策指引,建立产、学、研、用一体化机制,强化国际交流合作,不断推动深海生物资源的综合利用和可持续发展。
(备注:原创文章)
【参考文献】
[1] Ramirez-Llodra E, Brandt A, Danovaro R, et al. Deep, diverse and definitely different: unique attributes of the world’s largest ecosystem [J]. Biogeosciences, 2010, 7(9): 2851-2899.
[2] 沈满洪, 余璇. 习近平建设海洋强国重要论述研究 [J]. 浙江大学学报(人文社会科学版), 2018, 48(06): 5-17.
[3] Fu X M, Zhang M Q, Liu Y, et al. Protective exploitation of marine bioresources in China [J]. Ocean & Coastal Management, 2018, 163: 192-204.
[4] Wang Y N, Meng L H, Wang B G. Progress in research on bioactive secondary metabolites from deep-sea derived microorganisms [J]. Marine Drugs, 2020, 18(12): 614.
[5] O‘hanlon L H. Deep-sea creatures yield treasure trove of cancer drugs [J]. Nature Medicine, 2005, 11(7): 698-698.
[6] 廖静. 3500米深海微生物“炼”抗结核新药 [J]. 海洋与渔业, 2019, 03: 32-33.
[7] Wang L S, Wang J F, Liu J, et al. Antitubercular marine natural products [J]. Current Medicinal Chemistry, 2018, 25(20): 2304-2328.
[8] Lu W Y, Li H J, Li Q Y, et al. Application of marine natural products in drug research [J]. Bioorganic & Medicinal Chemistry, 2021, 35: 116058.
[9] Navarri M, Jegou C, Meslet-cladiere L, et al. Deep subseafloor fungi as an untapped reservoir of amphipathic antimicrobial compounds [J]. Marine Drugs, 2016, 14(3): 50.
[10] Zhong H H, Xu H N, Zhe R, et al. Anti-HSV-1, antioxidant and antifouling phenolic compounds from the deep-sea-derived fungus Aspergillus versicolor SCSIO 41502 [J]. Bioorganic & Medicinal Chemistry Letters, 2017, 27(4): 787-791.
[11] Calado M D, Silva J, Alves C, et al. Marine endophytic fungi associated with Halopteris scoparia (Linnaeus) Sauvageau as producers of bioactive secondary metabolites with potential dermocosmetic application [J]. Plos One, 2021, 16(5): e0250954.
[12] Alves A, Sousa E, Kijjoa A, et al. Marine-derived compounds with potential use as cosmeceuticals and nutricosmetics [J]. Molecules, 2020, 25(11): 2536.
[13] Esposito R, Ruocco N, Viel T, et al. Sponges and their symbionts as a source of valuable compounds in cosmeceutical field [J]. Marine Drugs, 2021, 19(8): 444.
[14] Agrawal S, Barrow C J, Deshmukh S K. Structural deformation in pathogenic bacteria cells caused by marine fungal metabolites: An in vitro investigation [J]. Microbial Pathogenesis, 2020, 146: 104248.
[15] Agrawal S, Barrow C J, Adholeya A, et al. Unveiling the dermatological potential of marine fungal species components: Antioxidant and inhibitory capacities over tyrosinase [J]. Biotechnology and Applied Biochemistry, 2021. DOI: 10.1002/bab.2201.
[16] Aranaz I, Acosta N, Civera C, et al. Cosmetics and cosmeceutical applications of chitin, chitosan and their derivatives [J]. Polymers, 2018, 10(2): 213.
[17] Shivankar A, Alok A, Colin J B, et al. Marine fungi: An untapped bioresource for future cosmeceuticals [J]. Phytochemistry Letters, 2018, 23: 15-20.
[18] Bovio E, Fauchon M, Toueix Y, et al. The sponge-associated fungus eurotium chevalieri MUT 2316 and its bioactive molecules: Potential applications in the field of antifouling [J]. Marine Biotechnology, 2019, 21(6): 743-752.
[19] Gao X X, Gao W, Cui Z S, et al. Biodiversity and degradation potential of oil-degrading bacteria isolated from deep-sea sediments of South Mid-Atlantic Ridge [J]. Marine Pollution Bulletin, 2015, 97(1-2): 373-380.
[20] 孙晓磊, 闫培生, 王凯, 等. 深海细菌及其活性物质防控植物病原真菌的研究进展 [J].生物技术进展, 2015, 5(03): 176-184.
[21] Wang J F, He W J, Huang X L, et al. Antifungal new oxepine-containing alkaloids and xanthones from the deep-sea-derived fungus Aspergillus versicolor SCSIO 05879 [J]. Journal of Agricultural and Food Chemistry, 2016, 64(14): 2910-2916.
[22] 韦海镧. 深海产黑色素细菌性质研究及HPPD抑制剂筛选模型构建 [D]. 国家海洋局第三海洋研究所, 2014.
[23] Lindell S, Rosinger C, Schmitt M, et al. HPPD herbicide-safener combinations as resistance breaking solutions for 21st century agriculture [C]// proceedings of the 13th IUPAC International Congress of Pesticide Chemistry – Discovery and Synthesis of Crop Protection Products., 2014, 1204: 219-231.
[24] 徐薇, 杜文琪, 赵世民. 深海鱼油,是保健圣品,还是广告噱头?[J]. 科学, 2021, 73(05): 37-39+4.
[25] 毛相朝. 现代生物技术在海洋功能性食品开发中的应用 [J]. 生物产业技术, 2019, (04): 11-15.
[26] Oh D Y, Talukdar S, Bae E J, et al. GPR120 is an omega-3 fatty acid receptor mediating potent anti-inflammatory and insulin-sensitizing effects [J]. Cell, 2010, 142(5): 687-698.
[27] 付秀梅, 薛振凯, 刘莹. “一带一路”背景下我国海洋生物医药产业发展研究 [J]. 中国海洋大学学报(社会科学版), 2019, (03): 21-30.
[28]刘峰, 刘予, 宋成兵, 等. 中国深海大洋事业跨越发展的三十年 [J]. 中国有色金属学报, 2021, 31(10): 2613−2623.
[29] Yan S, Minxiao W, Zhaoshan Z, et al. Adaption to hydrogen sulfide-rich environments: Strategies for active detoxification in deep-sea symbiotic mussels, Gigantidas platifrons [J]. Science of the Total Environment, 2022, 804: 150054.
[30] 胡学东, 高岩. 发展深海生物基因产业 助力蓝色经济腾飞 [N]. 2018-04-04(002).
[31] 肖吉. 基于专利信息的中国海洋药物技术分析 [J]. 中国科技信息, 2021(21): 20-22+10.
[32] 冯景春, 梁健臻, 张偲, 等. 深海生物资源开发装备发展研究 [J]. 中国工程科学, 2020, 22(06): 67-75.
网站支持
琼ICP备2022020235号